ゲノム編集
1.2023年 世界初のゲノム編集治療薬が承認される
2023年11月16日、英国医薬品・医療製品規制局(MHRA)は、ゲノム編集を使った治療薬を世界で初めて承認した。この治療薬は、Vertex社とCRISPER Therapeutics社が共同開発したCASGEVY(一般名:exagamglogene autotemcel:exa-cel)で、遺伝子の変異により正常な赤血球が作れず重度の貧血などを引き起こす鎌状赤血球症およびβ(ベータ)サラセミアを適応症とする。
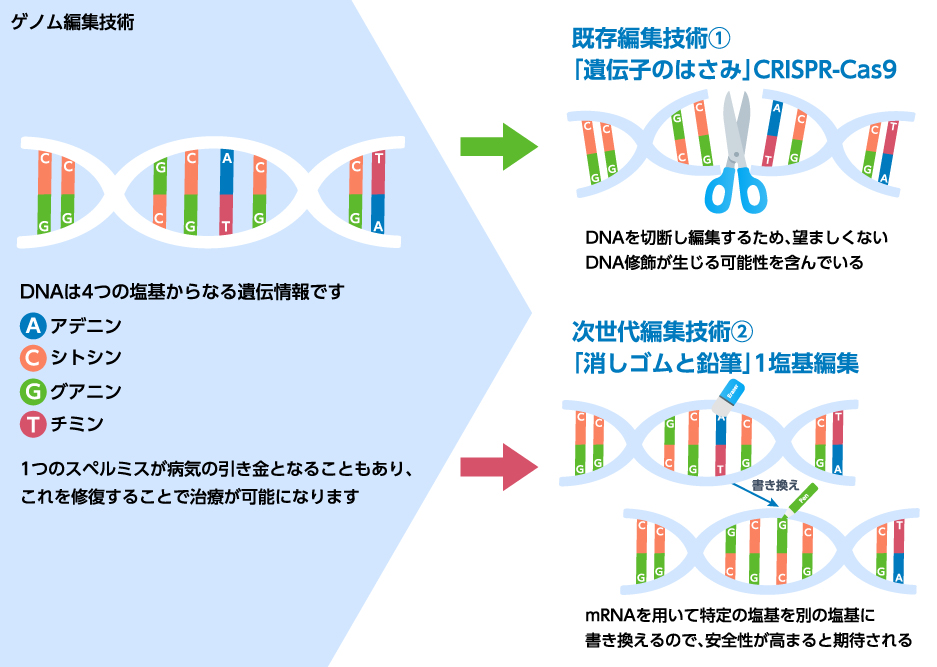
CASGEVYは患者の骨髄から造血幹細胞を採取し、体外でCRISPR(クリスパー)/Cas9(キャスナイン)酵素およびガイドRNAを用いてBCL11A遺伝子のエンハンサーの特定の部位にゲノム編集を行った後、それを体内に戻すものである。遂に、人類はゲノム編集と言う新たなmodalityを手に入れたことになるが、CASGEVYは体外でゲノム編集を行うex vivo治療であり、利便性の面では課題が残ると言える。
2.mRNAを用いたゲノム編集治療薬の開発が続く
Intellia Therapeutics社のNLAT-2001は、利便性に優るCRISPR/Cas9酵素をmRNAの形でヒトに静脈注射するタイプの治療薬である。家族性トランスサイレチンアミロイドーシスを対象としたPhase I試験成績が2021年の世界で最も権威ある医学雑誌の一つであるThe New England Journal of Medicine(NEJM)誌に掲載されている。
家族性トランスサイレチンアミロイドーシスは、トランスサイレチンが安定性を失ってアミロイドとなり、心臓や神経系などに蓄積し中枢神経障害、感覚運動性のニューロパチー、自律神経障害といった神経症状、腎障害、心筋障害、硝子体混濁などが生じる疾患である。
NLAT-2001
LNPが肝細胞に集まる性質を利用して肝細胞のトランスサイレチン遺伝子をノックアウトする。
Phase I試験において、合計6例の対象疾患患者にNLAT-2001が投与され、重篤な副作用を示すことなく投与量依存的な血液中トランスサイレチン濃度の低下が確認された。その後、高用量群が追加され、1 mg/kgでは血液中トランスサイレチン濃度の90%以上の低下および安全性が確認され、2023年10月28日にIntellia Therapeutics社は心アミロイドーシス型患者を対象とするPhase III試験の実施についてFDAと合意したことを発表している。
また、同社は同じタイプのゲノム編集薬NLAT-2002の開発も進めている。これは遺伝性血管性浮腫(Hereditary Angioedema (HAE)を適応としており、2022年のACAAおいて発表された。
NLAT-2002
Phase I/II試験の途中経過では、登録された10例の患者に重篤な副作用はなく、最高用量の75mgでは血漿中のkallikreinタンパク質が90%以上低下し、HAE発作頻度の明らかな低減が確認されており、今後Phase II試験に進むと発表している。
3.新たなゲノム編集技術にも注目が集まる
CRISPR/Cas9はDNAの二重鎖切断を伴う為、がん化或いは細胞毒性と言った懸念がある。このため、DNAの二重鎖切断を伴わない一塩基編集を応用した新たなゲノム編集技術が注目されている。CRISPR/Cas9システムのCas9のヌクレアーゼ活性を失活させ、デアミナーゼを融合させるもので、アデノシンデアミナーゼを用いる場合、アデニンをグアニンに“書き換える”ことが可能となる。
Verve Therapeutics社はこの原理を応用し、PSCK9遺伝子をオフさせ、血中のLDL-cholesterol(LDL-C)を低下させる一塩基編集型の治療薬VERVE-101を開発している。
VERVE-101
既にPhase I試験の初期成績が公開されており、0.6mg/kgまでの投与量まで重篤な副作用を示すことなく、PSCK9およびLDL-Cの低下が認められており、治験は継続中である。
臨床開発中のmRNAを用いたゲノム編集治療薬
